영국의 화학자이자 물리학자인 존 돌턴(1766~1844)은 1800년대에 혼합기체의 물리적인 성질 연구를 통해 부분 압력의 법칙을 발견하고 1803년에는 근대 원자론의 개념과 배수 비례의 법칙을 발견하였다. 돌턴은 물질은 당구공과 같이 딱딱하고 단단하여 쪼갤 수 없으나 움직일 수 있는 입자들인 ‘원자’로 구성되어 있다는 원자론을 주장하였다. 오늘날에는 원자란 양성자, 전자, 중성자와 같은 더 작은 입자로 구성되었음을 알게 되었지만, 근대적인 의미의 원자설은 돌턴의 업적으로부터 출발한다고 말할 수 있다. 자신의 원자설 즉 쪼개지지 않는 알갱이의 개념을 주장하기 위해 배수 비례의 법칙을 주장하였고, 이를 자신의 원자론으로 설명하였다. 두 가지 원소가 결합하여 화합물을 만들 때 일정량의 한 원소와 결합하는 다른 원소의 양 사이에는 간단한 정수비가 존재한다는 이론이다. 이 이론에서 정수비의 의미가 중요한데, 정수비란 1:1 또는 1:2와 같이 한 개 또는 두 개의 결합비를 의미하는 것이다. 다시 말해 원자는 화합물을 구성할 때 한 개나 두 개가 결합할 수는 있어도 0.5개, 1.3개 등 이런 결합비가 존재하지 않는다는 것을 의미하고 원자는 쪼개지지 않는다는 자신의 이론을 입증하는 증거라고 설명한다. 우리는 돌턴의 원자설을 가장 중요한 그의 업적으로 알고 있으나 원자론을 주장하기 이전 부분 압력의 법칙을 통해 혼합 기체의 성질에 관한 특성을 설명한 것도 돌턴의 중요한 업적 중의 하나이다. 서로 반응하지 않는 두 가지 기체가 같은 용기 속에 혼합되어 있을 때, 각 기체가 나타내는 압력을 기체의 부분압력 또는 부분압력이라고 말하며, 각 기체의 부분압력을 합하면 전체기체의 압력을 의미한다. 예를 들어 대기압이 1기압이고 대기 속에 산소와 질소만 존재한다고 가정한다면 산소와 질소의 각각의 부분압력을 더하면 대기압 1기압이 된다는 것이다. 대기 속의 산소가 20개, 질소가 80개가 존재한다면 산소의 부분압력은 0.2기압, 질소의 부분압력은 0.8기압이고 부분압력의 합인 1기압이 전체기체의 압력이 된다는 설명이다. 즉, 각 기체의 양 즉 몰수에 비례한다고 표현할 수 있다. 부분압력의 법칙을 다시 정리한다면 기체의 종류에 상관없이 혼합기체에서 전체기체의 압력은 전체기체의 양에 비례한다는 것이다. 또 다른 식으로 표현하면 각 기체의 부분압력은 전체 압력에 각 기체의 몰분율을 곱한 값과 같다고 표현할 수 있다. 몰분율이란 혼합기체에서 각 성분 기체의 양의 비율이다. 예를 들어 전체 대기 분자가 10개이고, 질소 8개, 산소 2개의 분자로 구성되었다고 가정한다면 질소의 몰분율은 0.8, 산소의 몰분율은 0.2, 여기에 전체 압력 1기압에 각각의 몰분율을 곱하면 질소의 부분압력은 0.8기압, 산소의 부분압력은 0.2기압이 되고, 각 각의 부분압력을 합하면 전체기압은 다시 1기압이 됨을 알 수 있다. 부분압력의 법칙을 이용하여 수상치환에서 기체의 압력을 구하는 과정을 알아보자.
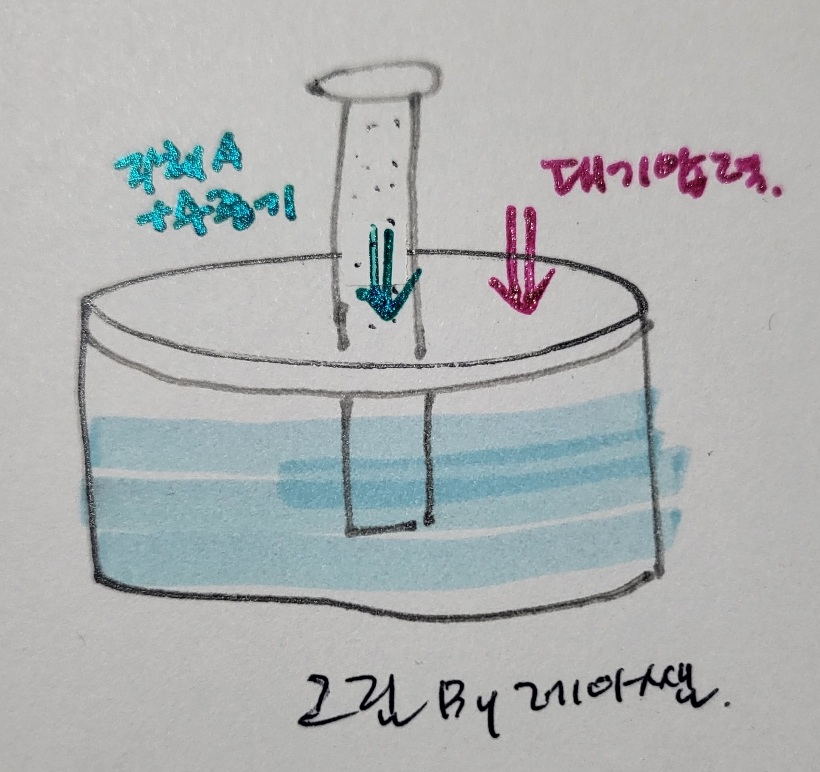
그림은 수상치환을 통해 물에 녹지 않는 기체 A를 포집한 실린더를 나타낸 그림이다. 실린더와 수조의 물 높이를 같게 조정하면 대기압력과 실린더 속의 기체의 압력은 같게 된다. 이때 실린더 속에는 기체 A와 수증기가 동시에 존재하므로 기체 A 만의 압력은 전체기압인 대기압에서 수증기압을 빼 기체 A의 압력을 구할 수 있다.
댓글