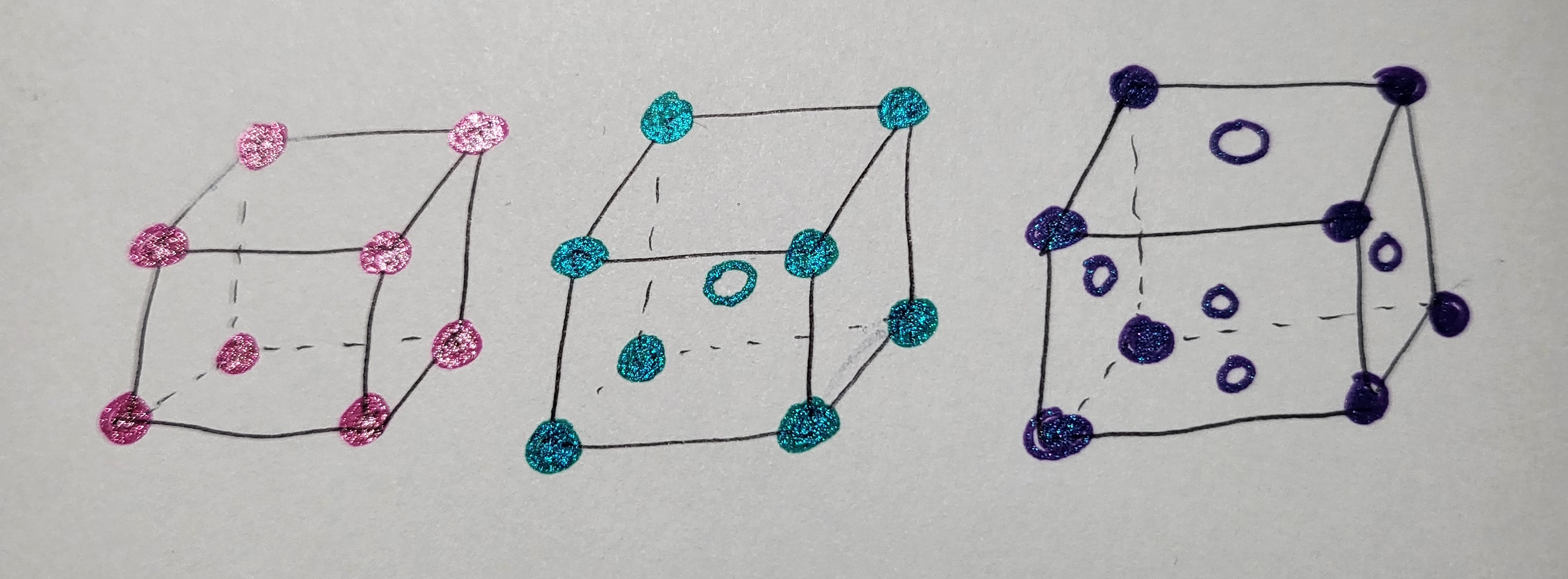
물질의 세 가지 상태인 기체, 액체, 고체 중 고체는 구성하는 입자들 사이의 인력이 가장 강하게 작용하여 입자들이 고정된 위치에서 진동운동만 한다. 따라서 일정한 모양을 가지고 유동성은 없으며, 압력과 온도변화에 따른 부피 변화가 거의 없다. 고체는 결정성고체와 비결정성고체로 나뉜다. 고체를 구성하는 입자의 배열이 규칙적이어서 입자의 결합을 끊어서 상태변화를 일으키는 에너지가 일정하므로 녹는점이 일정한 고체를 결정성 고체라고 한다. 예로 드라이아이스, 얼음 등이 결정성 고체에 해당한다. 반면 입자의 배열이 불규칙적이고 결합 중 일부는 먼저 끊어지고 다른 일부는 더 높은 온도에서 끊어져 녹는점이 일정하지 않은 고체를 비결정성고체라고 한다. 유리, 엿 등이 비결정성 고체에 해당한다. 고체의 종류를 나눌 때 화학결합의 종류로 분류하여 이온결정, 분자결정, 공유결정, 금속결정으로 분류한다. 첫째 이온결정은 양이온과 음이온의 전기적 인력에 의해 결정을 이룬 경우이다. 소금을 화학적으로 염화나트륨이라고 표현하는데 양이온인 나트륨이온과 음이온인 염화이온이 결합하여 염화나트륨을 형성한다. 전기적 결합력이 강하여 일반적으로 녹는점이 높고, 전기전도성은 없으나 액체 상태나 수용액 상태에서는 이온이 자유롭게 이동하여 전기가 잘 통한다. 소금 결정은 녹는점은 높으나 손으로도 쉽게 부서지는 특징이 있는데 그 이유는 외부의 힘을 받으면 층이 밀리면서 같은 전하의 이온끼리 가까워지게 되고 이 반발력으로 쉽게 부서지기 때문이다. 둘째 분자결정은 얼음과 같이 분자와 다른 분자 사이의 인력으로 고체가 되는 결정을 의미한다. 분자 사이의 힘은 다른 결정을 이루는 힘에 비해 약하여 녹는점이 낮고 일부는 승화성 물질인 경우도 있다. 분자 사이의 결합이 끊어져 상태변화가 일어날 때 원자 사이의 결합이 끊어지는 것은 아니고 분자 사이의 거리만 멀어져 상태변화만 일어난다. 세 번째 공유결정 또는 원자결정은 원자들 간의 공유결합으로 결정을 이루는 경우이다. 예를 들어 다이아몬드는 탄소가 공유결합으로 그물과 같이 촘촘하고 연속적인 구조를 이루어 결정을 만든다. 이때 다이아몬드에서는 탄소 분자라는 개념은 없다. 분자를 이루지 않고 탄소 원자가 직접 다른 탄소 원자와 공유결합을 통해 다이아몬드 결정을 이룬다. 다이아몬드가 상태변화를 하려면 강한 공유결합을 끊어야 하므로 많은 에너지가 있어야 한다. 따라서 공유결정의 경우 녹는 점이 매우 높고 결정의 강도도 매우 단단한 편이다. 공유결정의 기본 입자가 원자이므로 원자결정이라고 부르기도 하고, 전하를 이동시켜줄 입자가 존재하지 않아 전기전도성이 없으나 예외적으로 흑연만 전기가 흐르는 성질이 있다. 네 번째로 금속결정은 금속의 양이온과 자유전자 사이의 전기적 인력 즉 금속결합으로 결정을 이룬다. 주기율표에 존재하는 원소 중 약 80여개가 금속원소인데 이들은 모두 금속결정에 해당한다. 금속 결합력은 비교적 강하여 금속결정의 녹는점이 높고 단단하며, 자유전자의 빛 반사로 인해 금속 특유의 광택을 지닌다. 또한 자유전자가 자유롭게 이동할 수 있어 열 전도성과 전기전도성이 우수하다. 전성과 연성이 있어 외부의 힘에 의해 변형은 되어도 잘 부서지지 않는 특성이 있다. 결정의 구조는 결정을 구성하는 입자들의 배치에 따라 분류한다. 결정에서 규칙적인 배열이 반복되는 기본단위를 단위세포라고 하고, 정육면체 모양의 단위세포를 가지는 고체 결정의 격자구조에는 단순 입방구조, 체심 입방구조, 면심 입방구조가 있다. 단순 입방구조는 정육면체의 8개 꼭짓점에 각각 입자가 배열된 구조이고, 체심 입방구조는 정육면체의 8개 꼭짓점과 단위세포의 중심에 각각 입자가 배열된 형태이며, 면심 입방구조는 정육면체의 8개 꼭짓점과 6개의 면의 중심에 각각 입자가 배열된 구조이다.
댓글