산이란 물속에서 이온화하여 수소이온을 내놓는 물질로, 물에 녹아 대부분 이온화하는 물질을 강산, 일부만 이온화하는 산을 약산이라고 한다. 황산, 질산, 염산은 대표적인 강산이고 탄산과 아세트산은 약산이다. 염기는 물 속에서 이온화하여 수산화 이온을 내놓는 물질로, 대부분 이온화하는 염기을 강염기, 일부만 이온화하는 염기를 약염기라고 한다. 수산화나트륨, 수산화칼륨은 강염기이고 암모니아는 대표적인 약염기이다. 강산이나 강염기는 이온화 정도가 커서 수소 이온이나 수산화 이온이 많아 전기전도도가 크다. 반면 약산이나 약염기의 경우 전자를 이동시킬 이온의 수가 적어 전류의 세기가 약하다. 이온화도란 이온화 평형을 이루는 전해질 수용액에서 용해된 전해질의 몰수에 대한 이온화된 전해질의 몰의 비율을 의미하는 것으로 100% 이온화된다면 이온화도는 1로 표현된다. 강산이나 강염기는 이온화도가 1에 가깝고, 약산과 약염기는 이온화도가 매우 작다. 산과 염기도 이온화과정이 평형에 도달하였을 때, 평형상수를 구하는 식에 대입하여 이온화상수로 표현할 수 있다. 산과 염기의 이온화상수도 평형상수의 일종이므로 온도에 따라 변할 수 있다. 산의 이온화상수가 크다는 것은 강한 산을 의미하고, 염기의 이온화상수가 크다는 것은 평형상태에서 이온의 농도가 크다는 것을 의미하므로 강한 염기를 의미한다. 이온화상수를 이용하여 평형상태에서 수소 이온의 농도나 수산화 이온의 농도를 구할 수 있다. 산과 염기의 정의를 브뢴스테드-로우리의 개념으로 수소 이온 즉 양성자를 주면 산, 받으면 염기로 정의할 수 있다. 여기에서 산에 양성자의 이동에 의해 산과 염기가 되는 물질을 짝산-짝염기라고 표현한다. 산의 세기가 클수록 이온화되는 정반응이 우세하므로 산의 짝염기의 세기는 약하다. 산의 세기가 약할수록 이온화가 잘 되지 않고 역반응이 우세하므로 산의 짝염기의 세기는 강하다.
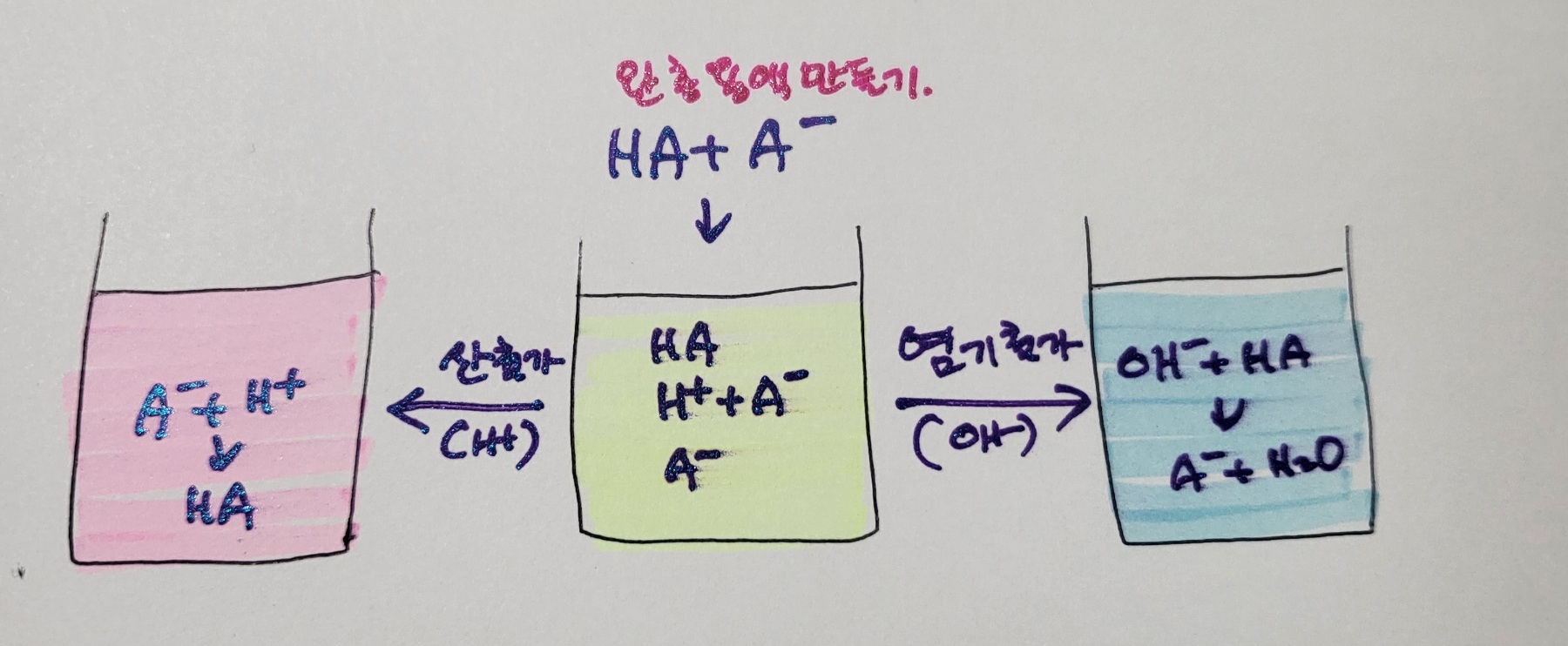
산의 음이온과 염기의 양이온이 만나서 결합한 물질을 염이라고 한다. 중화반응은 산과 염기가 만나서 물과 염이 되는 반응이다. 따라서 중화가 되었다면 용액의 pH는 항상 7이리고 생각할 수 있다. 이것은 강산과 강염기가 만나서 중화가 되는 경우에만 해당한다. 중화반응에서 생성된 염이 가수 분해되면 용액의 액성이 달라진다. 먼저 강산과 강염기의 반응에서 생성된 염은 물을 가수 분해하지 않아 중화반응 후 용액은 중성이다. 강산과 약염기의 반응에서 생성된 염은 물을 가수분해하여 수소이온을 생성하여 용액은 산성이 된다. 반면 약산과 강염기의 반응에서 생성되는 염은 물을 가수분해하여 수산화 이온을 생성하여 용액은 염기성이 된다. 약산과 약염기의 반응에서는 약산의 짝염기와 약염기의 짝산이 거의 같은 양의 수소 이온과 수산화 이온을 형성하므로 액성은 중성에 가깝게 된다. 산과 염기의 이온화 평형에서 pH가 거의 변하지 않는 용액을 만들 수 있는데 이것을 완충용액이라고 한다. 약산과 그 약산의 짝염기, 약염기와 그 약염기의 짝산으로 된 염을 녹여서 완충용액을 만드는데, 이 용액에 산이나 염기를 가해도 수용액에 포함된 이온과 같은 종류의 이온이 들어오면 그 이온의 농도를 감소시키려는 방향으로 반응이 일어나는 평형 이동이 일어나 수소 이온이나 수산화 이온의 수가 일정하게 유지되어 용액의 pH가 거의 일정하게 유지된다. 이것을 공통 이온 효과라고 부른다. 우리 몸 속의 혈액도 대표적인 완충용액이다. 예를 들어 탄산과 탄산수소이온이 약산과 약산의 짝염기로 평형을 이루고 있어 심한 운동으로 젖산이 생성되어 혈액으로 수소 이온이 증가하더라도 짝염기인 탄산수소 이온과 반응하여 탄산이 되어 혈액 내의 수소이온 농도는 증가하지 않아 혈액의 pH가 일정하게 유지된다. 그러므로 혈액은 이 세상에 존재하는 가장 훌륭한 완충용액이다.
댓글