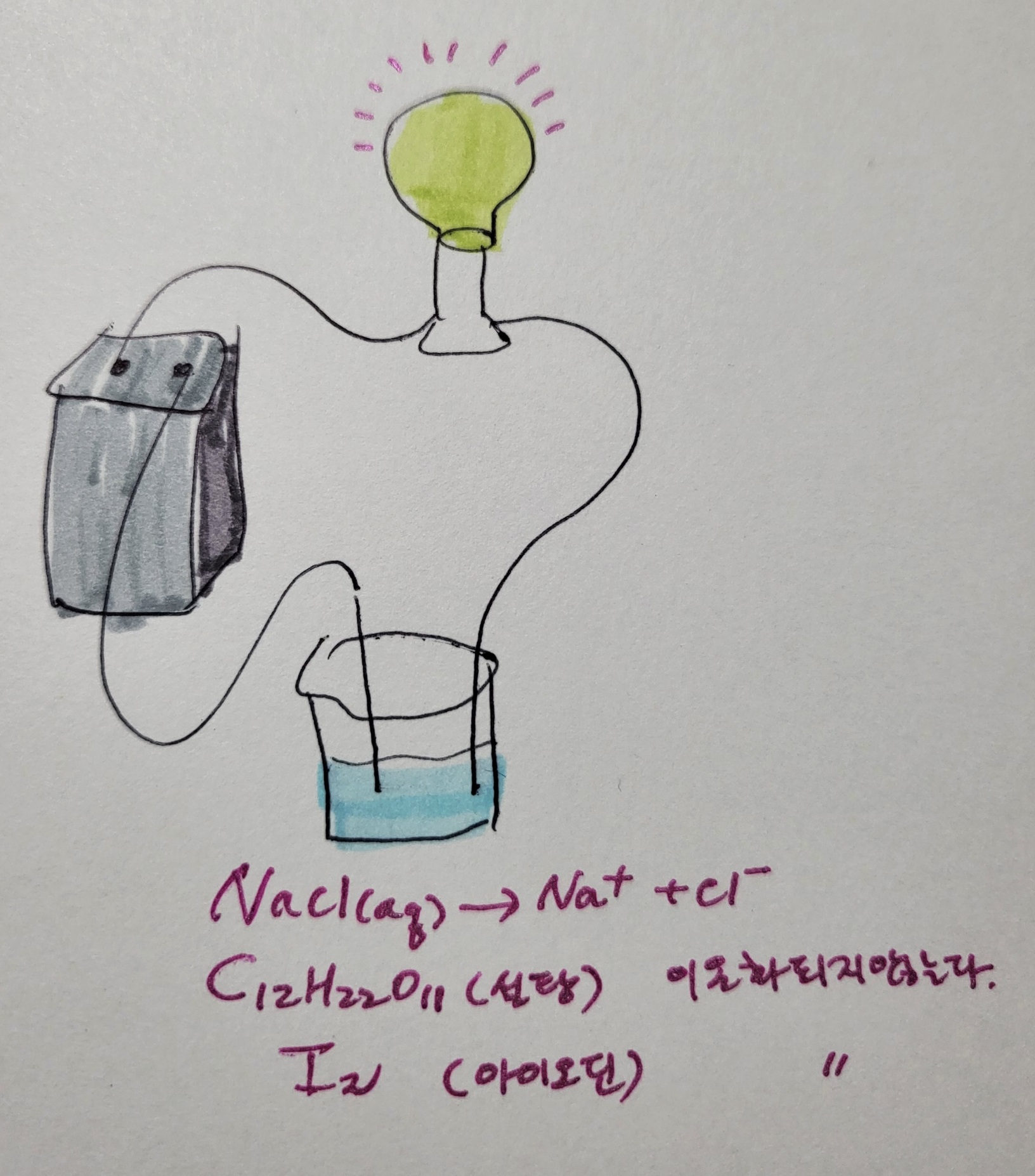
물질은 한 종류의 원소로 이루어진 물질을 원소 또는 홑원소물질이라고 하고 2종류 이상의 원소로 이루어진 물질을 화합물이라고 한다. 예를 들어 산소 기체는 산소로만 이루어져 있으므로 원소에 해당하고, 염화나트륨은 나트륨과 염소 2종류의 원소로 이루어져 있으므로 화합물이다. 산소 기체나 염화나트륨은 증기압력이나 끓는점, 녹는점 등 화학적 성질이 일정하다. 그런데 산소 기체와 수소 기체를 혼합하면 어떻게 될까? 또는 염화나트륨을 물과 혼합하면 어떻게 될까? 순수한 한 가지 물질만 존재할 때와는 전혀 다른 화학적 성질을 지니게 된다. 우리는 이렇게 두 가지 이상의 물질이 섞인 물질을 혼합물이라고 한다. 혼합물 중에도 흙탕물은 불균일혼합물이라고 부른다. 그 이유는 채취한 위치에 따라 물과 흙의 비율이 다르기 때문이다. 그러나 물과 설탕을 혼합한 용액의 경우 물과 설탕의 혼합된 비율이 일정한데 이것을 균일혼합물이라고 하고, 이 균일혼합물을 용액이라고 한다. 모든 기체 혼합물은 용액이다. 공기는 대표적인 기체 혼합물이고 기체 용액에 해당한다. 기체 용액의 경우 모두 한가지 상태로만 존재한다. 공기를 구성하고 있는 성분 물질들은 저마다 고유한 성질을 지닌다. 예를 들어 끓는점이 다 다르다. 따라서 냉각시키면 끓는점 차이를 이용하여 공기를 구성하는 성분 기체들을 분리해낼 수 있다. 고체용액도 존재한다. 한 원소의 원자들이 그들의 크기가 비슷한 다른 원소의 결정으로 들어가서 고체 혼합물을 만들기도 한다. 대표적인 예가 합금인데 구리와 금의 합금이나 강철 속에 녹아 있는 소량의 탄소가 고체 혼합물의 사례이다. 액체 용액의 사례는 우리 주변에서 흔히 볼 수 있다. 알코올과 물의 혼합물은 액체-액체의 용액이고, 물에 이산화탄소를 녹인 탄산수는 액체-기체의 용액에 해당한다. 설탕과 물의 경우 고체-액체의 용액에 해당한다. 이러한 용액의 경우 혼합되기 전의 순수한 물질의 증기압력보다 증기압이 낮아지는 현상이 일어난다. 이러한 증기압 내림 현상에 의한 끓는점 오름이나 어는점 내림을 설명하려면 용질이 얼마나 녹아 있는가를 알아내야 하고, 이렇게 용매와 용질의 혼합비율을 농도라는 개념으로 설명한다. 즉 농도란 용액의 진하기로, 용매에 용질의 혼합비율이라고 말할 수 있다. 화학에서 흔히 사용하는 농도로는 퍼센트 농도가 있다. 일상 생활에서도 많이 사용하는 농도로 용액 속의 용질의 질량비율을 백분율로 나타낸 것이다. 예를 들어 10%의 설탕물 용액 100g 속에는 설탕이 10g, 물이 90g이 존재함을 의미한다. 화학에서 많이 쓰는 두 번째 농도로는 몰농도가 있다. 용액 1L당 존재하는 용질의 몰수를 의미하는 농도이다. 예를 들어 설탕물 1M(몰농도) 1L가 존재한다면 그 속에 설탕이 1몰 존재한다는 의미이다. 설탕은 분자량이 342이므로, 설탕물 1000mL 속에 설탕 342g이 존재한다는 의미이다. 화학에서 많이 쓰는 농도에는 몰랄농도(m)도 있다. 몰랄농도는 용매 1kg당 존재하는 용질의 몰수를 의미한다. 설탕물 1몰랄 농도는 용매인 물 1kg 속에 설탕 1몰을 녹인 용액을 의미한다. 다시 말해 물 1000g에 설탕 1몰인 342g을 녹인 용액이다. 몰랄농도는 질량의 개념으로만 표현하므로 온도가 변하여도 농도가 변하지 않는 특성을 지닌다. 반면 몰농도는 용액의 부피를 사용하므로 온도에 따라 용액의 부피가 변하므로 농도도 변하는 특성이 있다. 이처럼 용액의 성질은 용질이 녹아 있는 함량이 중요하므로 용액의 성질을 연구하는 단계에서는 농도나 용해도의 개념으로 조성을 파악하는 것이 첫 번째 단계라고 할 수 있다. 흥미로운 용액의 성질에는 전기전도성이 있다. 설탕물은 전기가 흐르지 않지만 소금물은 전기가 잘 흐른다. 설탕은 에탄올에 잘 용해되지만 역시 전기가 흐르지 않는다. 요오드(아이오딘)은 물에는 잘 녹지 않지만 에탄올에는 잘 녹는다. 에탄올과 요오드 용액에도 전지가 잘 흐르지 않는다. 이러한 성질은 어떻게 설명할 수 있을까? 전기전도성을 결정하는 요인은 전하를 날라다 주는 입자의 존재 여부다. 설탕은 분자성 물질로 물이나 에탄올에 용해되어도 단지 분자 사이에 섞일 뿐 이온화되지 않아 전자를 이동시킬 수 없다. 반면 소금은 염화나트륨으로 물에서 나트륨 이온과 염화 이온으로 이온화되어 이온들이 전하를 이동시키는 역할을 한다. 그러나 요오드는 요오드 원자 2개가 결합한 분자성 물질로 무극성을 띠므로 물에는 용해되지 않지만, 에탄올에는 용해된다. 그러나 이온화되지 않아 전하를 날라주는 입자가 존재하지 않으므로 전기가 흐르지 않는다.
댓글